NGUYÊN
TỬ

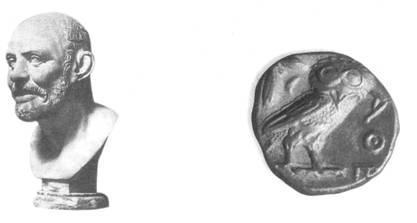
Hình 1.1.Tượng
Đê-mô-crit
Hình 1.2. Đồng tiền bằng bạc
(Democritus)
thời Đê-mô-crit
Vào khoảng năm 440 trước Công Nguyên, nhà triết học Đê-mô-crit cho rằng đồng tiền
bạc bị chia nhỏ mãi, sau cùng sẽ được một hạt "không thể phân chia được nữa",
gọi là Nguyên tử "xuất phát từ chữ Hi Lạp atomos, nghĩa là
"không chia nhỏ hơn được nữa"").
Ngày nay, người ta có thể phân chia được các nguyên tử bạc nhưng
các hợp phần thu được không còn giữ nguyên tính chất của
bạc nữa.
Cho đến giữa tận thế kỉ XIX, người ta cho rằng:
Các chất đều được tạo nên từ những hạt cực kì nhỏ bé không thể phân chia được nữa,
gọi là nguyên tử.
Những công trình thực nghiệm vào
cuối thế kỷ XIX, đầu thế kỉ XX đã chứng minh nguyên tử có thật và có cấu tạo phức
tạp.
I. THÀNH PHẦN CẤU TẠO CỦA NGUYÊN TỬ
1. Electron
a) Sự tìm ra electron
Năm 1897, nhà bác học người Anh Tôm-xơn (J.J.Thomson) nghiên cứu
sự phóng điện giữa hai điện cực có điện thế 15 kV, đặt trong một ống gần như
chân không (áp suất khoảng 0,001 mmHg) và thấy màn huỳnh quang trong ống phát
sáng do những tia phát ra từ cực âm và được gọi là tia âm cực.
Tia âm cực có các đặc tính sau: 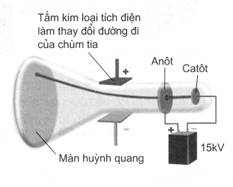
- Trên đường đi của nó, nếu ta đặt một chong chóng nhẹ thì chong
chóng bị quay. Điều đó cho thấy tia âm cực là chùm hạt
vật chất có khối lượng và chuyển động với vận tốc lớn.
- Khi không có tác dụng của điện trường và từ
trường thì tia âm cực truyền thẳng.
- Khi cho tia âm cực đi vào giữa hai bản
điện cực mang điện tích trái dấu, tia âm cực lệch về phía cực dương. Điều đó chứng
tỏ tia âm cực là chùm hạt mang điện tích âm (hình
1.3). Click ở đây để xem minh họa.
Người ta gọi những hạt tạo thành tia âm
cực là electron, kí hiệu là e.
b) Khối lượng và điện tích của electron
Bằng thực nghiệm, người ta đã xác
định được khối lượng và điện tích của electron.
Khối lượng: me = 9,1094.10-31
kg
Điện tích: qe = - 1,602.10-19 C (culông)
Người ta chưa phát hiện được điện tích nào nhỏ hơn
1,602.10-19 C nên nó được dùng làm điện tích đơn vị, kí hiệu là e0.
Do đó, điện tích của electron được kí hiệu là -e0 và quy ước bằng
1-.
2. Sự tìm ra hạt nhân nguyên tử
Năm 1911, nhà vật lí người Anh Rơ-dơ-pho (E.Rutherford) và các cộng
sự đã cho các hạt a(1) bắn phá một lá vàng mỏng và
dùng màn huỳnh quang đặt sau lá vàng để theo dõi đường đi của hạt a. Kết quả thí nghiệm cho thấy hầu hết các hạt a đều xuyên thẳng qua lá vàng, nhưng có một số
ít hạt đi lệch hướng ban đầu và một số rất ít hạt bị bật lại phía sau khi gặp
lá vàng (hình 1.4a, b). Click ở đây để
xem minh họa.
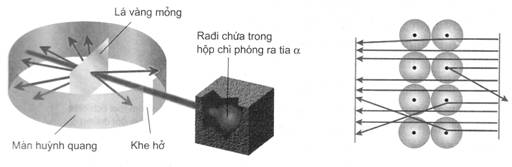
a)
b)
Hình 1.4. Mô hình thí nghiệm
khám phá ra hạt nhân nguyên tử
Như vậy, nguyên tử phải chứa phần mang điện dương có khối lượng
lớn để có thể làm các hạt a bị lệch khi va chạm. Nhưng phần mang điện tích dương
này lại phải có kích thước rất nhỏ so với kích thước nguyên tử để phần lớn các
hạt a có thể xuyên qua khoảng cách giữa
các phần mang điện tích dương của các nguyên tử vàng mà không bị lệch hướng.
Điều đó chứng tỏ nguyên tử có cấu tạo rỗng, phần mang điện
dương là hạt nhân (hình 1.4b).
Xung quanh hạt nhân có các
electron tạo nên vỏ nguyên tử. Để nguyên tử trung hoà về điện, số đơn vị điện tích dương của hạt
nhân đúng bằng số electron quay xung quanh hạt nhân.
Vì khối lượng của các electron rất
nhỏ nên khối lượng nguyên tử hầu như tập trung ở hạt nhân.
3. Cấu tạo của hạt nhân nguyên tử
a) Sự tìm ra proton
Năm 1918, khi bắn phá hạt nhân nguyên tử nitơ bằng hạt a, Rơ-dơ-pho đã quan sát thấy sự xuất hiện hạt nhân nguyên tử oxi
và một loại có khối lượng 1,6726.10‑27 kg,
mang một đơn vị điện tích dương (kí hiệu là e0; quy ước bằng 1+). Đó chính là hạt proton, được kí hiệu bằng chữ p.
Hạt proton là một thành phần cấu tạo
của hạt nhân nguyên tử.
b) Sự tìm ra notron
Năm 1932, Chat-uých (J.Chadwick) (cộng tác viên của Rơ-dơ-pho)
dùng hạt a bắn phá hạt nhân nguyên tử beri
đã quan sát thấy sự xuất hiện của một loạt hạt mới có khối lượng xấp xỉ khối lượng
của proton, nhưng không mang điện, được gọi là hạt nơtron (kí hiệu bằng chữ n).
Như vậy,
nơtron cũng là một thành phần cấu tạo của hạt nhân nguyên tử.
c) Cấu tạo của hạt nhân nguyên tử
Sau các thí nghiệm trên, người ta đi đến kết luận:
Hạt nhân nguyên tử được tạo thành
bởi các proton và nơtrron. Vì nơtron không mang điện, số proton trong hạt nhân phải bằng số
đơn vị điện tích dương của hạt nhân và bằng số electron quay xung quanh hạt nhân.
II. KÍCH THƯỚC VÀ KHỐI LƯỢNG CỦA NGUYÊN TỬ
Ngày nay, các nhà khoa học đã xác
định được kích thước và khối lượng các hạt tạo nên nguyên tử.
Nguyên tử của các nguyên tố khác
nhau có kích thước và khối lượng khác nhau.
1. Kích thước
Nếu hình dung nguyên tử như một quả cầu,
trong đó có các electron chuyển động rất nhanh xung quanh hạt nhân, thì nó có
đường kính khoảng 10-10m.
Để biểu thị kích thước nguyên tử, người ta dùng đơn vị nanomet
(viết tắt là nm) hay angstrom (![]() ).
).
Anm = 10-9m; 1![]() = 10-10m; 1
nm = 10
= 10-10m; 1
nm = 10 ![]()
a) Nguyên tử nhỏ nhất là nguyên tử hiđro có bán kính khoảng
0,053nm.
b) Đường kính của hạt nhân nguyên tử còn nhỏ
hơn, vào khoảng 10-5nm.
Như vậy, đường kính của nguyên tử
lớn hơn đường kính của hạt nhân khoảng 10000 lần (![]() ).
).
Nếu ta hình dung hạt nhân là quả cầu có đường kính 10cm thì
nguyên tử là quả cầu có đường kính 1000 m = 1km.
c) Đường kính của electron và của proton còn nhỏ hơn nhiều (khoảng
10-8nm), electron chuyển động xung quanh hạt nhân trong không gian rỗng
của nguyên tử.
2. Khối lượng
Ta khó tưởng tượng được rằng 1g của bất kì chất nào cũng chứa tới
hàng tỉ tỉ nguyên tử.
Thí dụ: 1 g cacbon có tới 5.1022
(50 000.109.109) nguyên tử cacbon (tức là năm mươi nghìn
tỉ tỉ nguyên tử cacbon).
Vì vậy, để biểu thị khối lượng của nguyên tử, phân tử và các hạt
proton, nơtron, electron người ta phải dùng đơn vị khối lượng nguyên tử, kí hiệu
là u(2),
u còn được gọi là đvC.
1 u bằng ![]() khối
lượng của một nguyên tử đồng vị cacbon -12.
khối
lượng của một nguyên tử đồng vị cacbon -12.
Nguyên tử cacbon này có khối lượng là 19,9265.10-27kg.
1u = ![]()
Khối lượng của 1 nguyên tử hiđro là 1,6738.10-27
kg » 1,008u »1u.
Khối lượng của 1 nguyên tử cacbon là 19,9265.10-27
kg » 12u.
Khối lượng, điện tích của các hạt
cấu tạo nên nguyên tử được ghi trong bảng 1.
Bảng 1. Khối lượng và điện
tích của các hạt tạo nên nguyên tử
|
Đặc
tính hạt |
Vỏ
nguyên tử |
Hạt
nhân |
|
|
electron
(e) |
proton
(p) |
nơtron
(n) |
|
|
Điện
tích q |
qe
= -1,602.10-19C = -e0=1- |
qp
= -1,602.10-19C = -e0=1+ |
qn
= 1 |
|
Khối
lượng m |
me
= 9,1094.10-31 kg me
» 0,00055u |
mp
= 1,6726.10-27 kg me
» 1u |
mn = 1,6748.10-27 kg me
» 1u |
I. HẠT NHÂN NGUYÊN TỬ
1. Điện tích hạt nhân
a) Proton mang điện tích 1+, nếu
hạt nhân có Z proton thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích
hạt nhân bằng Z.
b) Nguyên tử trung hoà về điện
nên số proton trong hạt nhân bằng số electron của nguyên tử. Vậy trong nguyên tử:
Số đơn vị điện tích hạt nhân Z = số proton = số electron
Thí dụ: Số đơn vị điện tích hạt nhân
của nguyên tử nitơ là 7, vậy nguyên tử nitơ có 7 proton và 7 electron.
2. Số khối
a) Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z)
và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó:
A = Z + N
Thí dụ: hạt nhân nguyên tử liti có 3
proton và 4 nơtron, vậy số khối của hạt nhân nguyên tử liti:
A = 3 + 4 = 7
b) Số đơn vị điện tích hạt nhân Z và số khối A đặc trưng cho hạt
nhân và cũng đặc trưng cho nguyên tử, vì khi biết X và A của một nguyên tử sẽ
biết được số proton, số electron và cả số nơtrron trong nguyên tử đó ( = A -
Z).
Thí dụ: Nguyên tử Na có A = 23 và Z =
11, suy ra nguyên tử Na có 11 proton, 11 electron và 12 nơtron.
II. NGUYÊN TỐ HOÁ HỌC
1. Định nghĩa
Tính chất hoá học của nguyên tố phụ thuộc vào số electron của
nguyên tử nguyên tố đó là do đó phụ thuộc vào số đơn vị điện tích hạt nhân Z của
nguyên tử. Như vậy, các nguyên tử có cùng số đơn vị điện tích
hạt nhân Z thì có cùng tính chất hoá học.
Định nghĩa: Nguyên tố hoá học là những nguyên tử có cùng điện
tích hạt nhân.
Thí dụ: Tất cả các nguyên tử có cùng
số đơn vị điện tích hạt nhân là 11 đều thuộc nguyên tố natri. Chúng đều có 11 proton và 11 electron.
Cho đến nay, người ta đã biết 92
nguyên tố hoá học có trong tự nhiên và khoảng 18 nguyên tố nhân tạo được tổng hợp
trong các phòng thí nghiệm hạt nhân (tổng số khoảng 110 nguyên tố).
2. Số hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi
là số hiệu nguyên tử của nguyên tố đó, kí hiệu là Z.
3. Kí hiệu nguyên tử
Số đơn vị điện tích hạt
nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Để kí hiệu nguyên
tử, người ta thường đặt kí hiệu các chỉ số đặc trưng ở bên trái kí hiệu nguyên
tố X với số khối A ở phía trên, số hiệu nguyên tử Z ở phía dưới: ![]() .
.
Thí dụ:
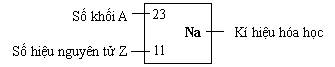
Kí hiệu trên cho ta biết:
Số hiệu nguyên tử của nguyên tố Na là 11 nên số đơn vị điện tích
hạt nhân nguyên tử là 11, trong hạt nhân có 11 proton và vỏ electron của nguyên
tử Na có 11 electron. Số khối của
nguyên tử Na là 23 nên trong hạt nhân có 12 (23 - 11 = 12) nơtron.
III. ĐỒNG VỊ
Các nguyên tử của cùng một nguyên
tố hoá học có thể có số khối khác nhau vì hạt nhân của các nguyên tử đó có số
proton như nhau nhưng có thể có số nơtron khác nhau.
Các đồng vị của cùng một nguyên tố hoá học
là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó khối A của chúng khác nhau.
Các đồng vị được
xếp vào cùng một vị trí (ô nguyên tố) trong bảng tuần hoàn.
Thí dụ, nguyên tố hiđro có ba đồng vị:
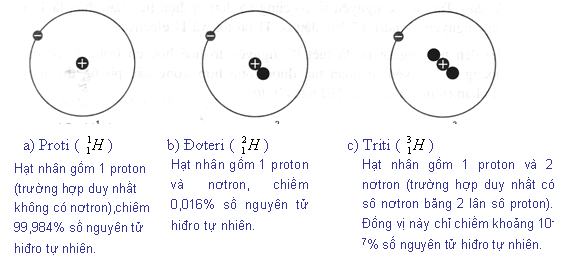
Hình 1.5. Sơ
đồ cấu tạo nguyên tử ba đồng vị của nguyên tố hiđro
Ngoài khoảng 340 đồng vị tự nhiên, người ta
đã tổng hợp được hơn 2400 đồng vị nhân tạo. Nhiều đồng vị nhân tạo được dùng
trong y học, nông nghiệp, nghiên cứu khoa học ...
IV. NGUYÊN TỬ KHỐI VÀ NGUYÊN TỐ KHỐI TRUNG
BÌNH CỦA CÁC NGUYÊN TỐ HOÁ HỌC
1. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của
nguyên tử.
Nguyên tử khối của một nguyên tử cho biết
khối lượng của nguyên tố đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của một nguyên tử bằng tổng khối
lượng của proton, nơtron và electron trong nguyên tử đó, nhưng do khối lượng của
electron quá nhỏ bé so với hạt nhân có thể bỏ qua nên khối lượng của nguyên tử
coi như bằng tổng khối lượng của các proton và nơtron trong hạt nhân nguyên tử.
Như vậy, nguyên tử khối coi như bằng số khối
(khi không cần độ chính xác cao).
Thí dụ: Xác định nguyên tử khối của P biết rằng P
có Z = 15 và N = 16. Nguyên tử khối của P là 31.
2. Nguyên tử khối trung bình
Nhiều nguyên tố hoá học tồn tại nhiều đồng
vị trong tự nhiên nên nguyên tố khối của các nguyên tố này là nguyên tử khối
trung bình của các đồng vị đó.
Giả sử một nguyên tố có hai đồng vị là X và
Y; X là nguyên tử của đồng vị X; Y là nguyên tử của đồng vị Y; a là phần trăm số
nguyên tử của đồng vị X; b là phần trăm số nguyên tử của đồng vị Y. Công thức
tính nguyên tử khối trung bình ![]() là:
là:
![]()
Trong những tính toán không cần độ
chính xác cao, có thể dùng số khối thay cho nguyên tố khối.
Thí dụ: Clo là hỗn hợp của hai đồng vị
bền ![]() chiếm 75,77% và
chiếm 75,77% và
![]() chiếm 24,23% tổng số nguyên tử clo trong
tự nhiên.
chiếm 24,23% tổng số nguyên tử clo trong
tự nhiên.
Nguyên tử khối trung bình của clo là:
![]()
ỨNG DỤNG
CỦA ĐỒNG VỊ PHÓNG XẠ VÀ SỬ DỤNG
NĂNG LƯỢNG HẠT NHÂN VÌ MỤC ĐÍCH HOÀ BÌNH
1. Sự phân rã hạt nhân - phóng xạ và phân hạch
Tính phóng xạ là tính chất của một số hạt nhân nguyên tử không bền
có thể tự biến đổi và phát ra các bức xạ hạt nhân (thường được gọi là các tia phóng xạ). Các nguyên tử có tính phóng
xạ gọi là các đồng vị phóng xạ, còn các nguyên tử không phóng xạ gọi là các đồng
vị bền. Các nguyên tố chỉ gồm các đồng vị phóng xạ
(không có đồng vị bền) gọi là nguyên tố phóng xạ.
Tia phóng xạ có thể là chùm các hạt mang điện dương như hạt a (phóng xạ a), hạt proton;
mang điện âm như chùm hạt electron (phóng xạ b); không mang điện như hạt nơtron hoặc tia
g (có bản chất giống như ánh sáng
nhưng năng lượng lớn hơn nhiều). Sự tự biến đổi như vậy của hạt
nhân nguyên tử, thường gọi là sự phân rã phóng xạ hay phân rã hạt nhân.
Tự phận hạch là quá trình hạt nhân của các nguyên tử phóng xạ có
số khối lớn như ![]() tự vỡ ra thành các mảnh hạt nhân
kèm theo sự thoát ra nơtron và một số hạt cơ bản khác.
Tự phân hạch cũng là một dạng của sự phân rã hạt nhân.
tự vỡ ra thành các mảnh hạt nhân
kèm theo sự thoát ra nơtron và một số hạt cơ bản khác.
Tự phân hạch cũng là một dạng của sự phân rã hạt nhân.
Trong tự phân hạch và phân rã phóng xạ đều có sự hụt khối lượng
tức là tổng khối lượng của các hạt tạo thành nhỏ hơn khối lượng của hạt nhân
ban đầu. Khối lượng bị hao hụt này chuyển hoá thành năng lượng khổng lồ được
tính theo phương trình nổi tiếng của Anh-xtanh
(A.Einstein):
DE = Dm.c2
(1)
Trong đó, DE (J) là năng lượng
thoát ra khi phân rã hạt nhân (năng lượng này nằm trong động năng của các hạt
thoát ra khi phân rã hạt nhân và năng lượng của bức xạ g);Dm
(g) là độ hụt khối; c = 2,988.108 m/s là vận tốc ánh sáng trong chân
không.
2. Ứng dụng của các đồng vị phóng xạ
Mặc dù mãi tới năm 1896, hiện tượng phóng xạ mới được nhà bác học
người Pháp Bec-cơ-ren (Becquerel) phát hiện, nhưng các đồng vị phóng xạ đã
nhanh chóng đóng vai trò đáng kể trong lịch sử phát triển của thế kỉ XX và thế
kỉ chúng ta đang sống. Ứng dụng đồng vị phóng xạ trong các lĩnh vực khác nhau của
kỹ thuật và đời sống chủ yếu dựa trên hai yếu tố: (1) Tương tác mạnh của tia
phóng xạ với môi trường vật chất mà nó đi qua; (2) Do sự phát tia phóng xạ, các
đồng vị phóng xạ dễ được phát hiện bằng các máy đo phóng xạ, nên có thể đóng
vai trò của các nguyên tử đánh dấu. Sau đây là một vài thí dụ
về ứng dụng đồng vị phóng xạ.
a) Trong nghiên cứu sinh học và nông nghiệp
Trong những thành tựu rực rỡ gần
đây của nghiên cứu di truyền học, giải mã gen, tìm hiểu sự vận chuyển các axít
amin trong cơ thể sinh vật... vai trò của các nguyên tử đánh dấu là rất quan trọng.
Các tia phóng xạ có năng lượng lớn, gây
ra các đột biến gen tạo thành các giống mới với nhiều tính chất ưu việt. Đây là cơ sở của cách mạng xanh trên thế giới. Tia g của đồng vị 60Co
là tác nhân tiệt trùng, chống nấm mốc hữu hiệu trong bảo quản lương thực, thực
phẩm và các loại hạt giống.
b) Ứng dụng đồng vị phóng xạ trong y học
Trong y học, các đồng vị phóng xạ
được dùng rộng rãi trong các hoạt động nghiên cứu, chẩn đoán và điều trị. Các hợp chất đánh dấu hoá phóng xạ cung cấp các thông tin giải
phẫu học về nội tạng con người, về hoạt động của các cơ quan riêng biệt, phục vụ
cho chẩn đoán bệnh. Tia phóng xạ được sử dụng trong các
phương pháp chụp cắt lớp. Từ lâu người ta đã sử dụng đồng
vị 131I trong chẩn đoán và điều trị bệnh tuyến giáp. Tia g có thể hội tụ tạo thành chùm tia có
năng lượng lớn, được sử dụng như một lưỡi dao sắc (dao gamma) trong các ca mổ
không chảy máu đối với của khối u nằm sâu trong não, mà bệnh nhân không cần phải
gây mê và có thể đi lại được ngay sau ca mổ... Năm 2005, một thiết bị "dao
gama" như vậy đã được đưa vào sử dụng ở Việt
c) Ứng dụng đồng vị phóng xạ trong công nghiệp và nghiên cứu
khoa học
Phương pháp nguyên tử đánh dấu được dùng rộng rãi để theo dõi sự
di chuyển của nước mặt, nước ngầm, kiểm tra tốc độ thấm qua đê, đập, thăm dò dầu
khí, nghiên cứu cơ chế của các phản ứng phức tạp và đo đạc các hằng số hoá lí.
Tia g (với khả năng
đâm xuyên mạnh) cho phép kiểm tra độ đặc khít của bê tông và các vật liệu kết
phối, phát hiện các khuyết tật nứt, gẫy nằm sâu trong vật liệu mà không phải
phá mẫu.
Năng lượng của tia phóng xạ có thể gây
ra nhiều biến đổi hoá học, biến tính nhiều vật liệu tạo ra các vật liệu mới với
những tính chất cực kì độc đáo.
Các phương pháp hạt nhân có khả
năng phát hiện tạp chất ở nồng độ rất nhỏ (10-8 - 10-9),
đã làm thay đổi đáng kể diện mạo của Hoá học phân tích hiện đại. Phân tích đồng vị cho phép xác định tuổi của mẫu đá hoặc mẫu
hoá thạch...
3. Sử dụng năng lượng phân hạch
Sự phân hạch giải phóng một năng
lượng khổng lồ. Từ phương trình (1), người ta
tính ra rằng năng lượng phân hạch của 1 kg 235U, có thể tích cỡ một
quả bóng ten-nit, tương đương với năng lượng thu được khi đốt cháy 2000 tấn
than (số than này phải chuyên chở bằng 200 chuyến xe tải 10 tấn), hoặc năng lượng
của sự nổ 20000 tấn thuốc nổ TNT. Năng lượng phân hạch của
urani được sử dụng trong các nhà máy điện hạt nhân. Năm
2005, năng lượng này đã cung cấp khoảng 16% tổng sản lượng điện của thế giới.
Điện hạt nhân hầu như không phát
thải khí CO2 và các khí thải độc hại khác, chi phí nhiên liệu thấp,
có thể là một lựa chọn hợp lí cho sự phát triển bền vững của nước ta và nhiều
quốc gia khác.
4. Bảo vệ phóng xạ
| Tia phóng xạ có thể ảnh hưởng nghiêm trọng đến sức khoẻ con người và động, thực vật. Khi làm việc với các đồng vị phóng xạ, phải tôn trọng triệt để các quyết định về an toàn hạt nhân. Các chất thải phóng xạ phải được xử lý theo các quy trình nghiêm ngặt và chôn chất thải trong các kho được xây dựng đặc biệt. Đối với chất thải hoạt độ cao, các kho thải phải an toàn trong thời gian hàng vạn năm. |  |
A. KIẾN THỨC CẦN NẮM VỮNG
1. Nguyên tử được tạo nên bởi electron và hạt nhân. Hạt nhân được
tạo nên bởi proton và nơtron
qe = 1,602.10-19C, quy ước bằng 1-; me » 0,00055u.
qe = 1,602.10-19C, quy ước bằng 1+; mp » 1u.
qn = 0; mn » 1u.
2. Trong nguyên tử, số đơn vị điện tích hạt nhân Z = số proton =
số electron
Số khối A = Z + N
Nguyên tử khối coi như bằng tổng sổ
các proton và các nơtron (gần đúng).
Nguyên tử khối của một nguyên tố
có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị đó.
Nguyên tố hoá học là những nguyên
tử có cùng số Z.
Các đồng vị của một nguyên tố hoá
học là các nguyên tử có vùng số Z, khác số N.
3. Số hiệu nguyên tử Z và số khối A đặc
trưng cho nguyên tử
Kí hiệu nguyên tử: ![]()
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
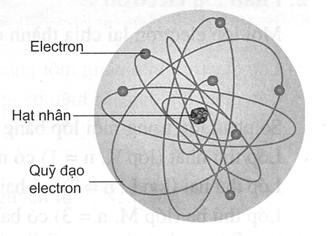 Những năm đầu của thế kỉ XX, người ta cho rằng các electron chuyển
động xung quanh hạt nhân nguyên tử theo những quỹ
đạo tròn hay bầu dục, như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
Đó là mô hình mẫu hành tinh nguyên tử của Rơ-dơ-pho, Bo (N.Bohr) và
Zom-mơ-phen (A.Sommerfeld).
Những năm đầu của thế kỉ XX, người ta cho rằng các electron chuyển
động xung quanh hạt nhân nguyên tử theo những quỹ
đạo tròn hay bầu dục, như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
Đó là mô hình mẫu hành tinh nguyên tử của Rơ-dơ-pho, Bo (N.Bohr) và
Zom-mơ-phen (A.Sommerfeld).
Mô hình này có
tác dụng rất lớn đến sự phát triển lý thuyết cấu tạo nguyên tử, nhưng không đầy
đủ để giải thích mọi tính chất của nguyên tử.
Ngày nay, người ta đã biết các electron
chuyển động rất nhanh (tốc độ hàng nghìn km/s) trong khu vực xung
quanh hạt nhân nguyên tử không theo những quỹ đạo xác định tạo nên vỏ nguyên
tử số electron ở vỏ nguyên tử của một nguyên tố đúng bằng số proton trong
hạt nhân nguyên tử và cũng bằng số hiệu nguyên tử (Z) hay số thứ tự của nguyên
tố đó trong bảng tuần hoàn. Chẳng hạn, vỏ của nguyên tử hiđro (Z = 1) có 1
electron, vỏ của nguyên tử clo (Z = 17) có 17 electron, vỏ của nguyên tử vàng
(Z = 79) có tới 79 electron..., vậy các electron được phân bổ như thế nào ?
Các kết quả nghiên cứu cho thất
chúng phải phân bố theo những quy luật nhất định.
II. LỚP ELECTRON VÀ PHÂN LỚP ELECTRON
1. Lớp electron
Các electron trong nguyên tử ở trạng
thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp thành
từng lớp. Các electron ở
gần nhân hơn liên kết bền chặt hơn với hạt nhân. Vì vậy,
electron ở lớp trong có mức năng lượng thấp hơn so với ở các lớp ngoài.
Các electron trên cùng một lớp có
mức năng lượng gần bằng nhau.
Xếp theo thứ tự mức
năng lượng từ thấp đến cao, các lớp electron này được ghi bằng các số nguyên
theo thứ tự n = 1, 2, 3, 3... với tên gọi: K, L, M, N,
...
n =
1
2
3
4 ...
Tên lớp
K
L
M N
...
2. Phân lớp electron
Mỗi lớp electron lại
chia thành các phân lớp
Các electron phân lớp
được kí hiệu bằng các chữ cái thường s, p, d, f.
Số phân lớp trong mỗi
lớp bằng số thứ tự của lớp đó.
Lớp thứ nhất (lớp K, n
= 1) có một phân lớp, đó là phân lớp 1s.
Lớp thứ hai (lớp L, n
= 2) có hai phân lớp, đó là phân lớp 2s và 2p.
Lớp thứ ba (lớp M, n =
3) có ba phân lớp, đó là phân lớp 3s, 3p và 3d...
Các electron ở phân lớp
s được gọi là các electron s, ở phân lớp p được gọi là các electron p...
III. SỐ ELECTRON TỐI ĐA TRONG MỘT PHÂN LỚP,
MỘT LỚP
Số electron tối đa
trong một phân lớp như sau:
- Phân lớp s chứa tối
đa 2 electron;
- Phân lớp p chứa tối
đa 6 electron;
- Phân lớp d chứa tối
đa 10 electron;
- Phân lớp f chứa tối
đa 14 electron;
Phân lớp electron đã
có đủ số electron tối đa gọi là phân lớp electron bão hoà. Từ đó suy ra số
electron tối đa trong một lớp:
1. Lớp thứ nhất (lớp
K, n = 1) có 1 phân lớp 1s, chứa tối đa 2 electron.
2. Lớp thứ hai (lớp L,
n = 2) có 2 phân lớp 2s và 2p.
- Phân lớp 2s chứa tối
đa 2 electron.
- Phân lớp 2p chứa tối
đa 6 electron.
Vậy, lớp thứ hai chứa
tối đa 8 electron.
3. Lớp thứ ba (lớp M,
n = 3) cớ 3 phân lớp 3s, 3p và 3d.
- Phân lớp 3s chứa tối
đa 2 electron.
- Phân lớp 3p chứa tối
đa 6 electron.
- Phân lớp 3d chứa tối
đa 10 electron.
Vậy, lớp thứ ba chứa tối
đa 18 electron.
Từ các thí dụ trên rút
ra rằng: Số electron tối đa của lớp thứ n là 2n2
Dựa vào công thức này
tính được lớp thứ tư (lớp N, n = 4) chứa tối đa 2.42 = 32 electron.
Lớp electron đã có đủ
số electron tối đa gọi là lớp electron bão hoà
Bảng 2. Số electron tối đa trong các lớp
và các phân lớp (n - 1 đến 3)
|
Lớp
electron |
Số
electron tối
đa của lớp |
Phân
bố electron trên
các phân lớp |
|
Lớp
K (n = 1) |
2 |
1s2 |
|
Lớp
L (n = 2) |
8 |
2s22p6 |
|
Lớp
M (n = 3) |
18 |
3s23p63d10 |
Thí dụ: Xác định số lớp electron của
các nguyên tử ![]()
![]()
Số đơn vị điện tích hạt nhân của nguyên tử nitơ là 7, suy ra hạt
nhân có 7 proton, vỏ nguyên tử có 7 electron được phân bố như sau: 2 electron
trên lớp K (n = 1), 8 electron trên lớp L (n - 2) và 2 electron trên lớp M (n =
3) xem 2 hình 1.7.
|
|
|
|
|
|
Hình 1.7. Sơ đồ sự phân bố electron trên các lớp của nguyên tử nitơ và
magie (Vòng tròn trong cùng tượng trưng cho hạt nhân có chứa nơtron (n) và
proton), các vòng tròn ngoài tượng trưng cho các lớp electron
Obitan nguyên tử
là một hàm số toán học mô tả trạng thái của một electron trong nguyên tử. Vì là một hàm số, nên hình dạng của các
obitan nguyên tử là những mô hình toán học chứ không phải mô hình vật lí.
Thí dụ, một electron trong nguyên
tử hiđro chuyển động cực nhanh trong khu vực không gian gần hạt nhân nguyên tử
tạo thành một đám mây electron (hình 1.8).
Mật độ điện tích của đám mây
electron đó lớn nhất ở bên trong một hình cầu có bán kính 0,053nm. Ở khu vực đó, khả năng có mặt electron là khoảng
90%. Ta nói đó là obitan s.

Hình 1.8. Đám mây electron hình cầu của nguyên tử hiđro
Như vậy: Obitan nguyên tử là khu vực không gian xung quanh hạt
nhân, tại đó xác suất có mặt (hay xác suất tìm thấy) electron là khoảng 90%.
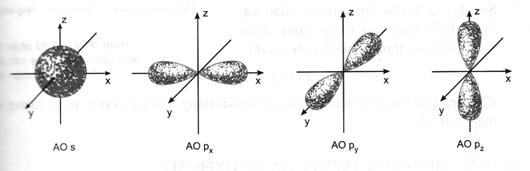
Hình 1.9. Hình dạng của các obitan s và p
Ở phân lớp d có 5 obitan d, hình dạng
phức tạp hơn.
Mỗi obitan hứa tối đa 2 electron nên:
Phân lớp s có 1 obitan s chứa tối đa 2
electron.
Phân lớp p có 3 obitan p chứa tối đa 6
electron.
Phân lớp d có 5 obitans d chứa tối đa 10
electron.
Khái niệm obitan nguyên tử giúp ta hiểu các
khái niệm khác như: Sự lai hoá các obitan, liên kết s (xích ma), liên kết p (pi) sẽ được học sau này.
CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
 I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN
TỬ
I. THỨ TỰ CÁC MỨC NĂNG LƯỢNG TRONG NGUYÊN
TỬ
Các electron trong nguyên tử ở trạng thái
cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.
Từ trong ra ngoài, mức năng lượng của các lớp
n tăng thứ tự từ 1 đến 7 và năng lượng của phân lớp tăng theo thứ tự s, p, d,
f.
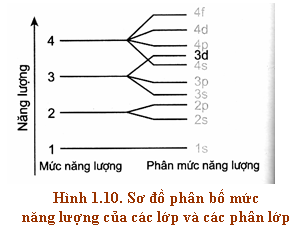
Sau đây là thứ tự sắp xếp các phân lớp theo
chiều tăng của năng lượng được xác định bằng thực nghiệm và lý thuyết:
1s 2s 3s 3p 4s 3d 4p 5s
... (hình 1.10)
Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng nên mức năng lượng
4s thấp hơn 3d.
II. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
1. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự
phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Người ta quy ước cách viết cấu hình electron
của nguyên tử như sau:
- Số thứ tự electron được ghi bằng chữ số
(1, 2, 3,...)
- Phân lớp được ghi bằng các chữ cái thường
(s, p, d, f).
- Số electron trong một phân lớp được ghi bằng
số ở phía trên bên phải của phân lớp (s2, p6...).
Cách viết hình electron của nguyên tử gồm
các bước sau:
Bước 1: Xác định số electron của nguyên tử.
Bước 2: Các electron được phân bố lần lượt
vào các phân lớp theo chiều tăng của năng lượng trong nguyên tử (1s 2s 3s 3d 4s
4p 5s...) và tuân theo quy tắc sau: phân lớp s chứa tối đa 2 electron; phân lớp
p chứa tối đa 7 electron; phân lớp d chứa tối đa 10 electron; phân lớp f chứa tối
đa 14 electron.
Bước 3: Viết cấu hình electron biểu diễn sự
phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 3s 3p 4s 3p
4d 5s ...).
Thí dụ:
- Nguyên tử hiđro, Z =
1, có 1 electron. Cấu hình của nguyên tử H là 1s1.
- Nguyên tử heli, Z = 2, có 2 electron. Cấu
hình của nguyên tử He là 1s2, đã bão hoà.
- Nguyên tử liti, Z = 3, có 3
electron. Cấu hình của nguyên tử Li là 1s22s1
. Electron cuối cùng của nguyên tử liti điền vào phân lớp s. Liti
là nguyên tố s.
- Nguyên tử clo, Z = 17, có 17 electron. Cấu
hình của nguyên tử Cl được viết như sau: 1s22s22p63s23p5
.
hoặc viết gọn là: [Ne] 3s23p5.
Electron cuối cùng của nguyên tử clo điều
vào phân lớp p. Clo là nguyên tố p. [Ne] là kí hiệu cấu hình của nguyên tử
neon, là khí hiếm gần nhất đứng trước clo.
- Nguyên tử sắt, Z = 56, có 56 electron. Các electron của nguyên tử Fe được phân bố như sau: 1s22s22p63s23p64s23d6.
Electron cuối cùng của nguyên tử
Fe điền vào phân lớp d, Fe là nguyên tố d.
Cấu hành electron của nguyên tử Fe: 1s22s22p63s23p64s23d64s2.
Hoặc viết gọn là: [Ar] 3d64s2.
Vậy:
Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền
vào phân lớp s.
Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền
vào phân lớp p.
Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền
vào phân lớp d.
Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền
vào phân lớp f.
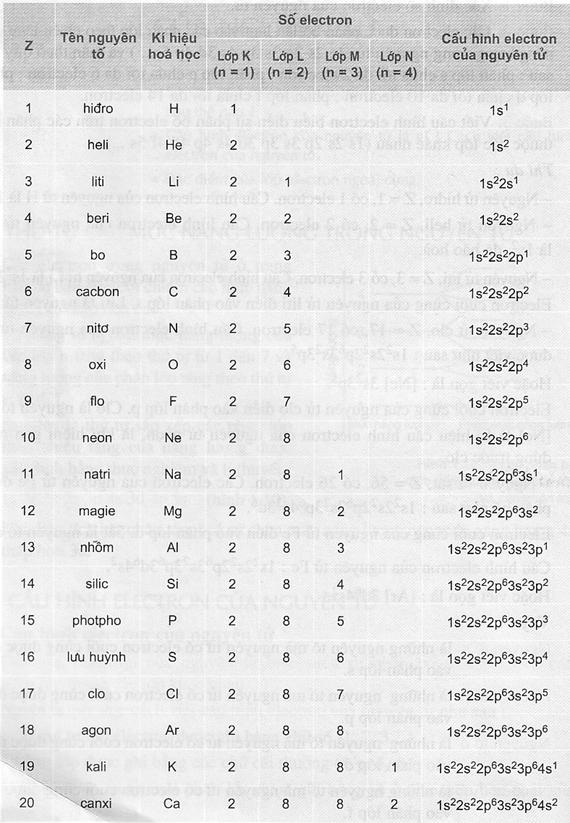
2. Cấu hình electron nguyên tử của 20 nguyên tố đầu (xem bảng)
Có thể viết cấu hình electron theo lớp/
Thí dụ: Cấu hình electron của Na là 1s22s22p63s1
hay có thể được viết theo lớp là 2, 8, 1.
3. Đặc điểm của lớp electron ngoài cùng
- Đối với nguyên tử của tất cả các
nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron.
- Các nguyên tử có 8 electron ở lớp electron ngoài cùng (ns2np6)
và nguyên tử heli (1s2) không tham gia vào các phản ứng hoá học (trừ
trong một số điều kiện đặc biệt) vì cấu hình electron của các nguyên tử này rất
bền. Đó là các nguyên tử của nguyên tố khí hiếm. Trong tự nhiên, phân tử khí hiếm chỉ có một nguyên tử.
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng dễ nhường
electron là nguyên tử của các nguyên tố kim loại (trừ
H, He và B).
- Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng dễ nhận
electron thường là nguyên tử của các nguyên tố phi kim.
- Các nguyên tử có 4 electron ngoài cùng có thể là nguyên tử của
các nguyên tố kim loại hoặc phi kim (xem bảng tuần
hoàn)
Như vậy, khi cấu hình electron của
nguyên tử có thể dự đoán được loại nguyên tố.
A. KIẾN THỨC CẦN NẮM VỮNG
Bảng 3. Lớp và phân lớp
electron
|
Số thứ tự lớp (n) |
1 |
2 |
3 |
4 |
... |
|
Tên
của lớp |
K |
L |
M |
N |
... |
|
Số
electron tối đa |
2 |
8 |
18 |
32 |
... |
|
Số
phân lớp |
1 |
2 |
3 |
4 |
... |
|
Kí
hiệu phân lớp |
1s |
2s,
2p |
3s,
3p, 3d |
4s,
4p, 4d, 4f |
... |
|
Số electron tối đa ở phân lớp và ở lớp |
2 |
2,6 |
2, 6, 10 |
2, 6, 10, 14 |
... |
|
|
|
|
|||
|
8 |
18 |
32 |
Bảng 4. Mối liên hệ giữa
lớp electron ngoài cùng với loại nguyên tố
|
Cấu hình electron lớp ngoài
cùng |
ns1, ns2, ns2 np1 |
ns2 np2 |
ns2 np3,
ns2 np4, và ns2 np5, |
ns2 np6
(He
: 1s2) |
|
Số electron thuộc lớp ngoài
cùng |
1,
2 hoặc 3 |
4 |
5,
6 hoặc 7 |
8
(2 ở He) |
|
Loại nguyên tố |
kim
loại (trừ H, He, B) |
Có
thể là kim loại hay phi kim |
thường
là phi kim |
Khí
hiếm |
|
Tính chất cơ bản của nguyên
tố |
tính
kim loại |
có
thể là tính kim loại hay tính phi kim |
thường
có tính phi kim |
tương
đối trơ về mặt hoá học |