TỐC ĐỘ PHẢN ỨNG VÀ CÂN BẰNG HOÁ HỌC
|
|
Đèn xì axetilen - oxi dùng để hàn, cắt kim loại. Nhiệt độ của ngọn lửa axetilen cháy trong oxi cao hơn nhiều (đạt khoảng 30000C) so với cháy trong không khí ... | ||
| Lơ-Sa-tơ-li-ê (Le Chatelier (1850 - 1936), tác giả của nguyên lí chuyển dịch cân bằng) |
|
||
I- KHÁI NIỆM VỀ TỐC ĐỘ PHẢN ỨNG HOÁ HỌC
1. Thí nghiệm
Chuẩn bị ba dung dịch : BaCl2, Na2S2O3 (1) và H2SO4 có cùng nồng độ 0,1M để thực hiện hai phản ứng sau:
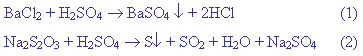
b) Đổ 25 ml
dung dịch H2SO4 vào cốc đựng 25 ml
dung dịch Na2SO3 một lát sau mới thấy
màu trắng đục của S xuất hiện.
2. Nhận xét
Từ hai thí nghiệm trên ta thấy
rằng, phản ứng (1) xảy ra nhanh hơn phản ứng
(2). Nói chung các phản ứng hoá học khác nhau xảy ra
nhanh, chậm rất khác nhau. Để đánh giá mức
độ xảy ra nhanh, chậm của các phản ứng
hoá học, người ta đưa ra khái niệm tốc
độ phản ứng hoá học, gọi tắt là tốc
độ phản ứng.
Tốc độ phản ứng là độ biến thiên
nồng độ của một trong các chất phản ứng
hoặc sản phẩm trong một đơn vị thời
gian(2). Thí dụ:
Br2 + HCOOH --> 2HBr + CO2
Lúc đầu nồng độ Br2 là 0,0120 mol/l, sau
50 giây nồng độ là 0,0101 mol/l.
Tốc độ trung bình của phản ứng trong khoảng
thời gian 50 giây tính theo Br2 là:
![]()
II. CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG
1. Ảnh hưởng của nồng độ
Thí nghiệm. Thực hiện phản ứng (2) bằng cách chuẩn bị hai cốc dựng dung dịch Na2S2O3 với các nồng độ khác nhau, sau đó đổ đồng thời vào mỗi cốc 25ml dung dịch H2SO4 0,1 M như hình 7.1. Dùng đũa thuỷ tinh khuấy nhẹ dung dịch trong cả hai cốc. So sánh thời gian xuất hiện màu trắng đục(3) của lưu huỳnh trong hai cốc, ta thấy lưu huỳnh xuất hiện trong cốc (a) sớm hơn, nghĩa là tốc độ phản ứng trong cốc (a) lớn hơn.

Hình 7.1. Thí nghiệm ảnh hưởng của nồng độ đến tốc độ phản ứng
Vậy, khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
2. Ảnh hưởng của áp suất
Áp suất ảnh hưởng đến tốc độ phản ứng có chất khí. Khi áp suất tăng nồng độ chất khí tăng theo nên tốc độ phản ứng tăng.
Thí dụ, xét phản ứng sau thực hiện trong bình kín ở nhiệt độ xác định:
2HI (k) --> H2 (k) + I2 (k)
Tốc độ phản ứng khi áp suất của HI là 2 atm gấp 4 lần tốc độ phản ứng khi áp suất của HI là 1 atm.
3. Ảnh hưởng của nhiệt độ
Thí nghiệm : Thực hiện phản ứng (2) ở hai nhiệt độ khác nhau (hình 7.2).

Hình 7.2. Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Để thực hiện phản ứng trong cốc (b) cần đun nóng trước hai dung dịch Na2S2O3 và H2SO4. Sau đó đổ đồng thời vào mỗi cốc 25 ml dung dịch H2SO4 0,1M khuấy nhẹ. So sánh thời gian xuất hiện màu trắng đục của lưu huỳnh trong hai cốc, ta thấy lưu huỳnh xuất hiện trong cốc (b) sớm hơn.
Vậy, khi tăng nhiệt độ, tốc độ phản ứng tăng.
4. Ảnh hưởng của diện tích bề mặt
Thí nghiệm. Dùng hai mẫu đá vôi (CaCO3) có khối lượng bằng nhau, trong đó một mẫu có kích thước hạt nhỏ hơn. Cho hai mẫu đá đó cùng tác dụng với hai thể tích bằng nhau của dung dịch HCl (dư) cùng nồng độ (hình 7.3). Phản ứng xảy ra như sau:
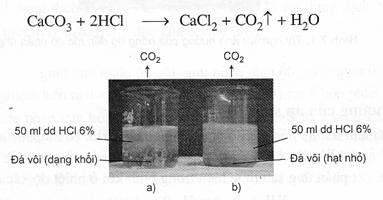
Hình 7.3. Thí nghiệm ảnh hưởng của diện tích bề mặt chất rắn
đến tốc độ phản ứng
Ta thấy thời gian để CaCO3 phản ứng hết trong cốc (b) ít hơn trong cốc (a) vì chất rắn với kích thước nhỏ (đá vôi dạng hạt nhỏ) có tổng diện tích bề mặt tiếp xúc với chất phản ứng (HCl) lớn hơn so với chất rắn có kích thước hạt lớn hơn (đá vôi dạng khối) cùng khối lượng, nên có tốc độ phản ứng lớn hơn. Vậy, khi tăng diện tích bề mặt phản ứng, tốc độ phản ứng tăng.
5. Ảnh hưởng của chất xúc tác
Chất xúc tác là chất làm tăng tốc độ phản ứng(4), nhưng còn lại sau khi phản ứng kết thúc.
Thí dụ, H2O2 phân huỷ chậm trong dung dịch ở nhiệt độ thường theo phản ứng sau:
2H2O2 --> 2H2O + O2
Nếu cho vào dung dịch này một ít bột MnO2, bọt oxi sẽ thoát ra rất mạnh khi phản ứng kết thúc, MnO2 vẫn còn nguyên vẹn. Vậy, MnO2 là chất xúc tác cho phản ứng phân huỷ H2O2.
Ngoài các yếu tố trên, môi trường xảy ra phản ứng, tốc độ khuấy trộn, tác dụng của các tia bức xạ v.v... cũng ảnh hưởng lớn đến tốc độ phản ứng.
III - Ý NGHĨA THỰC TIỄN CỦA TỐC ĐỘ PHẢN ỨNG
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất. Thí dụ, nhiệt độ của ngọn lửa axêtilen cháy trong ôxi cao hơn so với cháy trong không khí, nên tạo nhiệt độ càng cao hơn.Nấu thực phẩm nồi áp suất chóng chín hơn so với khi nấu chúng ở áp suất thường.Các chất đốt rắn như than, củi có kích thước nhỏ hơn sẽ cháy nhanh hơn. Để tăng tốc độ tổng hợp NH3 từ N2 và H2 , người ta phải dùng chất xúc tác, tăng nhiệt độ và thực hiện ở áp suất cao.
CHẤT XÚC TÁC MEN (ENZIM)
Các quá trình hoá học trong cơ thể sống xảy ra với tốc độ nhanh chóng và nhịp nhàng là có men. Men là chất xúc tác sinh học. Men không những làm tăng tốc độ phản ứng hoá học từ 106 đến 1012 lần, mà còn có tính đặc thù rất cao: hoạt tính xúc tác của men được thể hiện ngay ở điều kiện áp suất và nhiệt độ bình thường của cơ thể, một chất men chỉ làm xúc tác cho một số chất phản ứng xác định, trong khi đó những chất còn lại có mặt trong hệ thống bị ảnh hưởng. Trong cơ thể người có tới gần 30000 chất men khác nhau. Chúng xúc tác cho hầu hết các phản ứng hoá học xảy ra trong cơ thể. Chẳng hạn, men trong nước bọt là amilaza xúc tác cho sự chuyển hoá tinh bột thành đường; men trong dạ dày là pepxin xúc tác cho sự phân giải các protein.
Men có thể tồn tại được ở ngoài cơ thể sống và vẫn bảo toàn được khả năng xúc tác. Ngày nay, người ta đã tổng hợp được và tách được từ tế bào sống rất nhiều men khác nhau để dùng trong nhiều lĩnh vực như trong y học, công nghiệp thực phẩm, công nghiệp dược phẩm... Một số thí dụ: Trong công nghiệp thực phẩm, men được dùng trong sản xuất rượu, bia, bánh mì, kẹo bánh, chế biến thịt, cá, sữa...; Trong y học và công nghiệp dược phẩm, men được dùng trong sản xuất các vitamin, chất kháng sinh, để chữa các bệnh men bẩm sinh.v.v....
I- NỘI DUNG THÍ NGHIỆM VÀ CÁCH TIẾN HÀNH
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
Chuẩn bị hai ống nghiệm như sau:
· ống thứ nhất chứa 3 ml dung dịch HCl nồng độ khoảng 18%.
· ống thứ hai chứa 3ml dung dịch HCl nồng độ khoảng 6%.
Cho đồng thời vào mỗi ống một hạt kẽm có kích thước giống nhau.
Quan sát hiện tượng xảy ra trong hai ống nghiệm và rút ra kết luận. Viết phương trình hoá học của phản ứng xảy ra.
2. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Chuẩn bị hai ống nghiệm, mỗi ống đựng 3 ml dung dịch H2SO4 nồng độ khoảng 15%. Đun dung dịch trong một ống đến gần sôi. Cho đồng thời vào mỗi ống một hạt Zn có kích thước giống nhau. Quan sát hiện tượng xảy ra trong hai ống nghiệm và rút ra kết luận. Viết phương trình hoá học của phản ứng xảy ra.
3. Ảnh hưởng của diện tích bề mặt chất rắn đến tốc độ phản ứng
Chuẩn bị hai ống nghiệm, mỗi ống đựng 3 ml dung dịch H2SO4 nồng độ khoảng 15%, sau đó chuẩn bị hai mẫu Zn có khối lượng bằng nhau. Một mẫu có kích thước hạt nhỏ hơn mẫu còn lại. Cho đồng thời hai mẫu kẽm đó vào hai ống nghiệm đựng H2SO4 ở trên. Quan sát hiện tượng xảy ra trong hai ống nghiệm và rút ra kết luận. Viết phương trình hoá học của phản ứng xảy ra.
II. VIẾT TƯỜNG TRÌNH
I - PHẢN ỨNG MỘT CHIỀU, PHẢN ỨNG THUẬN NGHỊCH VÀ CÂN BẰNG HOÁ HỌC
1. Phản ứng một chiều
Xét phản ứng sau:
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
Khi đun nóng các tinh thể KClO3 có mặt chất xúc tác MnO2 , KClO3 phân huỷ thành KCl và O2. Cũng trong điều kiện đó, KCl và O2 không phản ứng được với nhau tạo lại KClO3, nghĩa là phản ứng chỉ xảy ra theo một chiều từ trái sang phải. Phản ứng như thế gọi là phản ứng một chiều.
Trong phương trình hoá học của phản ứng một chiều, người ta dùng một mũi tên chỉ chiều phản ứng.
2. Phản ứng thuận nghịch
Xét phản ứng sau:

Ở điều kiện thường, Cl2 phản ứng H2O tạo thành HCl và HClO, đồng thời HCl va HClO sinh ra cũng tác dụng được với nhau tạo lại Cl2 và H2O, nghĩa là trong cùng điều kiện, phản ứng xảy ra theo hai chiều trái ngược nhau. Phản ứng như thế được gọi là phản ứng thuận nghịch.
Trong chương trình hoá học của phản ứng thuận nghịch, người ta dùng hai mũi tên ngược chiều nhau thay cho một mũi tên đối với phản ứng một chiều.
3. Cân bằng hoá học
Xét phản ứng thuận nghịch sau:
Cho H2 và I2
vào trong một bình kín ở nhiệt độ cao và không
đổi. Lúc đầu tốc độ
phản ứng thuận(vt) lớn
vì nồng độ H2 và I2 lớn, trong
khi đó tốc độ phản ứng nghịch (vn)
bằng không, vì nồng độ HI bằng không. Trong quá
trình diễn ra phản ứng nồng độ H2
và I2 giảm dần nên vt
giảm dần, còn vn tăng dần vì nồng độ
HI tăng dần. Đến một lúc nào đó vt trở nên bằng vn, khi đó
nồng độ các chất trong phản ứng thuận
nghịch trên đây được giữ nguyên, nếu
nhiệt độ không biến đổi. Trạng thái
này của phản ứng thuận nghịch được
gọi là cân bằng hoá học (Hình 7.4).

Ở trạng thái cân bằng, không phải là phản ứng dừng lại, mà phản ứng thuận và phản ứng nghịch vẫn xảy ra, nhưng với tốc độ bằng nhau (vt = vn). Điều này có nghĩa là trong một đơn vị thời gian, nồng độ các chất phản ứng giảm bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. Do đó, cân bằng hoá học là cân bằng động.
Vậy, cân bằng hoá học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
Đặc điểm của phản ứng thuận nghịch là các chất phản ứng không chuyển hoá hoàn toàn thành các sản phẩm, nên trong hệ cân bằng luôn luôn có mặt các chất phản ứng và các sản phẩm.
Thí dụ, cho 0,500 mol/l(5) I2 vào trong một bình kín ở nhiệt độ 4300C. Nếu phản ứng là một chiều thì H2 và I2 sẽ phản ứng hết tạo thành 1,000 mol/l HI. Nhưng đây là phản ứng thuận nghịch, nên chỉ thu được 0,786 mol/l HI và còn lại 0,107 mol/l H2, 0,107 mol/l I2.
II- SỰ CHUYỂN DỊCH CÂN BẰNG HOÁ HỌC
1. Thí nghiệm
Lắp một dụng cụ gồm hai ống
nghiệm có nhánh (a) và (b), được nối với nhau
bằng một ống nhựa mềm, có khoá K mở (hình
7.5).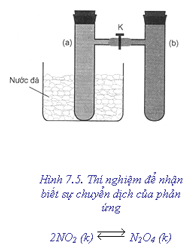
Nạp đầy khí NO2 vào cả hai ống (a) và (b) ở nhiệt độ thường. Nút kín cả hai ống, trong đó có cân bằng sau:
2NO2 (k)
↔ N2O4 (k)
(Màu nâu đỏ) (không màu)
Màu của
hỗn hợp khí trong cân bằng ở cả hai ống (a)
và (b) là như nhau.
Đóng khoá K lại để ngăn không cho khí ở hai ống
khuyếch tán vào nhau. Ngâm ống (a) vào nước đá. Một
lát sau lấy ra, so sánh màu ở ống (a) với ống
(b), ta thấy màu ở ống (a) nhạt hơn. Vậy,
khi ta làm lạnh ống (a), các phân tử NO2 trong ống
đó đã phản ứng thêm để tạo ra N2O4,
làm nồng độ NO2 giảm bớt và nồng
độ N2O4 tăng thêm. Hiện tượng
đó được gọi là sự chuyển dịch cân
bằng hoá học.
2. Định nghĩa
Sự chuyển dịch cân bằng hoá học là sự di
chuyển từ trạng thái cân bằng này sang trạng thái
cân bằng khác do tác động của các yếu tố từ
bên ngoài lên cân bằng.
Những yếu tố làm chuyển dịch cân bằng là nồng
độ, áp suất và nhiệt độ. Chúng được
gọi là các yếu tố ảnh hưởng đến
cân bằng hoá học.
III - CÁC YẾU TỐ ẢNH
HƯỞNG ĐẾN CÂN BẰNG HOÁ HỌC
1. Ảnh hưởng của
nồng độ
Xét hệ cân bằng sau trong một bình kín ở nhiệt
độ cao và không đổi:
![]()
Nếu ta cho thêm vào hệ một
lượng khí CO2, nồng độ CO2
trong hệ sẽ tăng lên làm cho ngay lúc đó vt trở
lên lớn hơn vn, CO2 sẽ phản ứng
thêm với C tạo ra CO2 cho đến khi vt
lại bằng vn, lúc đó cân bằng mới
được thiết lập, ở trạng thái cân bằng
mới, nồng độ các chất sẽ khác với ở
trạng thái cân bằng cũ.
Vậy, khi thêm CO2 vào hệ
cân bằng, cân bằng sẽ chuyển dịch theo chiều
từ trái sang phải (theo chiều thuận), chiều là giảm
nồng độ CO2 thêm vào.
Quá trình chuyển dịch cân bằng xảy ra tương tự
khi ta lấy bớt khí CO ra khỏi cân bằng, vì khi đó
vn < vt.
Ngược lại, nếu ta cho thêm khí CO vào hoặc lấy
bớt khí CO2 ra khỏi hệ cân bằng thì lúc
đó vt < vn, cân bằng sẽ chuyển
dịch từ phải trang trái (theo chiều nghịch) nghĩa
là theo chiều làm giảm nồng độ CO hoặc chiều
tăng nồng độ CO2.
Từ sự khảo sát ở trên ta thấy rằng, khi
tăng hoặc giảm nồng độ một chất
trong cân bằng thì cân bằng bao gờ cũng chuyển dịch
theo chiều tăng giảm tác dụng của việc
tăng hoặc giảm nồng độ của chất
đó.
Lưu ý rằng, nếu trong hệ cân bằng có chất rắn
(ở dạng nguyên chất), thì việc thêm hoặc bớt
lượng chất rắn không ảnh hưởng đến
cân bằng, nghĩa là cân bằng không chuyển dịch. Thí
dụ, nếu cho thêm hoặc lấy bớt lượng C
trong hệ cân bằng (1) thì cân bằng không bị ảnh
hưởng.
2. Ảnh hưởng của
áp suất
Xét hệ cân bằng (2) trong xi lanh kín có pít tông (hình 7.6) ở nhiệt độ thường và không đổi:
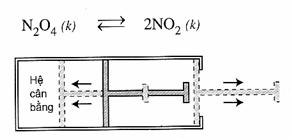
Hình 7.6. Thí nghiệm
chứng minh ảnh hưởng của
áp suất đến cân bằng
![]()
Thí nghiệm chứng tỏ rằng, khi hệ đang ở trạng thái cân bằng, nếu ta tăng áp suất chung của hệ lên, bằng cách đẩy pit tông vào để cho thể tích chung của hệ giảm xuống, thì số mol khí NO2 sẽ giảm bớt, đồng thời số mol khí N2O4 sẽ tăng thêm nghĩa là cân bằng chuyển dịch theo chiều nghịch.
Nhận xét: Nhìn vào phản ứng (2) ta thấy cứ 2 mol khí NO2 phản ứng tạo ra một mol khí N2O4, nghĩa là phản ứng nghịch làm giảm số mol khí trong hệ, do đó làm giảm áp suất chung của hệ.
Như vậy, khi tăng áp suất chung của hệ cân bằng trên, cân bằng chuyển dịch theo chiều nghịch, chiều làm giảm áp suất chung của hệ, nghĩa là chuyển dịch về phía làm giảm tác dụng của việc tăng áp suất chúng.
Bây giờ nếu ta làm giảm áp suất chung của hệ cân bằng trên bằng cách kéo pit tông ra để cho thể tích chung của hệ tăng lên, thì số mol khí NO2 sẽ tăng thêm, đồng thời số mol khí N2O4 sẽ giảm bớt. Vậy, cân bằng chuyển dịch theo chiều thuận, chiều làm tăng số mol khí trong hệ, nghĩa là chuyển dịch về phía làm giảm tác dụng của việc giảm áp suất chung.
Vậy, khi tăng hoặc giảm áp suất chung của hệ cân bằng, thì cân bằng bao giờ cũng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
Từ các thí nghiệm trên, ta suy ra: nếu phản ứng có số mol khí ở hai vế của phương trình hoá học bằng nhau hoặc phản ứng không có chất khí, thì áp suất không ảnh hưởng đến cân bằng. Thí dụ, áp suất không ảnh hưởng đến các cân bằng sau:
H2(k) + I2
(k) ![]() 2HI(k)
2HI(k)
Fe2O3 (r) + 3CO (k) ![]() 2Fe (r) + 3CO2 (k)
2Fe (r) + 3CO2 (k)
3. Ảnh hưởng của
nhiệt độ
Để nghiên cứu ảnh hưởng của nhiệt
độ đến cân bằng hoá học cần biết
khái niệm phản ứng toả nhiệt và phản ứng
thu nhiệt.
Các phản ứng hoá học thường kèm theo sự giải
phóng hoặc hấp thụ năng lượng dưới
dạng nhiệt. Thí dụ, khi cho vôi sống (caO) tác dụng
với nước, ta thấy hỗn hợp tạo thành
sôi lên. Phản ứng như thế là phản ứng toả
nhiệt. Ngược lại, khi nung đá vôi (CaCO3)
để sản xuất vôi sống, ta phải liên tục
cung cấp nhiệt cho phản ứng. Đó là phản ứng
thu nhiệt.
Để chỉ lượng nhiệt kèm theo mỗi phản
ứng hoá học, người ta dùng đại lượng
nhiệt phản ứng, ký hiệu là DH. Phản ứng toả nhiệt
thì các chất phản ứng mất bớt năng lượng
nên giá trị DH có dấu âm (DH < 0). Ngược lại,
phản ứng thu nhiệt, các chất phản ứng phải
lấy thêm năng lượng để tạo ra các sản
phẩm, nên giá trị DH có dấu dương (DH > 0). Thí dụ:
CaO + H2O ® Ca(OH)2
DH =
-65 kJ
CaCO3 ![]() CaO + CO2
DH = +
178 kJ
CaO + CO2
DH = +
178 kJ
Để nghiên cứu ảnh hưởng của nhiệt
độ đến cân bằng hoá học ta xét lại cân
bằng (2) trong bình kín:
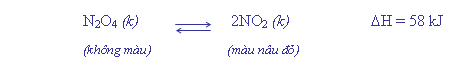
Phản
ứng thuận thu nhiệt (DH = 58 kJ >0). Phản ứng
nghịch thoả nhiệt (DH = -58 kJ < 0).
Khi hỗn hợp khí trên đang ở trạng thái cân bằng,
nếu đun nóng hỗn hợp khí bằng cách ngâm bình
đựng hỗn hợp vào nước sôi, màu nâu đỏ
của hỗn hợp khí đậm lên nghĩa là cân bằng
chuyển dịch theo chiều thuận, chiều của phản
ứng thu nhiệt.
Nếu làm lạnh bằng cách ngâm bình đựng hỗn hợp
khí vào nước đá, màu của hỗn hợp khí nhạt
đi, nghĩa là cân bằng chuyển dịch theo chiều
nghịch, chiều của phản ứng toả nhiệt(6)
.
Như vậy, khi tăng nhiệt độ, cân bằng
chuyển dịch theo chiều phản ứng thu nhiệt
nghĩa là chiều làm giảm tác dụng của việc
tăng nhiệt độ và khi giảm nhiệt độ
cân bằng chuyển dịch theo chiều phản ứng toả
nhiệt, chiều làm giảm tác dụng của việc giảm
nhiệt độ.
Kết luận
Ba yếu
tố nồng độ, áp suất và nhiệt độ ảnh
hưởng đến cân bằng hoá học đã
được Lơ Sa-tơ-li-e (H.L.Le Chatelier, 1860 - 1936,
nhà hoá học Pháp) tổng kết tành nguyên lý được
gọi là nguyên lý chuyển dịch cân bằng Lơ
Sa-tơ-li-e như sau:
Một phản ứng thuận nghịch đang ở trạng
thái cân bằng khi chịu một tác động từ bên
ngoài như biến đổi nồng độ, áp suất,
nhiệt độ thì cân bằng sẽ chuyển dịch
theo chiều làm giảm tác động bên ngoài đó.
4. Vai trò của chất xúc tác
Chất xúc tác là tăng tốc
độ phản ứng thuận và tốc độ phản
ứng nghịch với số lần bằng nhau, nên chất
xúc tác không ảnh hưởng đến cân bằng hoá học.
Khi phản ứng thuận nghịch chưa ở trạng
thái cân bằng thì chất xúc tác có tác dụng làm cho cân bằng
được thiết lập nhanh chóng hơn.
IV- Ý NGHĨA CỦA TỐC ĐỘ
PHẢN ỨNG, VÀ CÂN BẰNG HOÁ HỌC TRONG SẢN XUẤT
HOÁ HỌC
Để thấy ý nghĩa của tốc độ phản
ứng và cân bằng hoá học trong sản xuất hoá học,
chúng ta lấy một số thí dụ sau đây:
Thí dụ 1: Trong quá trình sản xuất axit
sunfuric phải thực hiện phản ứng sau
2SO2
(k) + O2 (k) ![]() 2SO3(k) (DH <
0)
2SO3(k) (DH <
0)
Trong phản ứng này người ta dùng oxi không khí.
Ở nhiệt độ thường, phản ứng xảy
ra rất chậm. Để tăng tốc độ phản
ứng phải dùng chất xúc tác và thực hiện phản
ứng ở nhiệt độ khá cao. Nhưng đây là phản
ứng toả nhiệt, nên khi tăng nhiệt độ,
cân bằng chuyển dịch theo chiều nghịch làm giảm
hiệu suất của phản ứng. Để hạn
chế tác dụng này, người ta đã dùng một
lượng dư không khí, nghĩa là tăng nồng độ
ôxi, làm cho cân bằng chuyển dịch theo chiều thuận.
Thí dụ 2: Trong công nghiệp, amoniac được
tổng hợp theo phản ứng sau:
N2 (k) + 3H2 ![]() NH3 (
NH3 (
Đặc điểm của phản ứng này là tốc
độ rất chậm ở nhiệt độ thường,
toả nhiệt và số mol khí của sản phẩm ít
hơn so với số mol khí của các chất phản ứng.
Do đó, người ta phải thực hiện phản ứng
này ở nhiệt độ cao, áp suất cao và dùng chất
xúc tác. ở áp suất cao, cân bằng chuyển dịch sang
phía tạo ra NH3,nhưng ở nhiệt độ
cao, cân bằn chuyển dịch ngược lại, nên chỉ
thực hiện được ở nhiệt độ
thích hợp.
MỘT
PHƯƠNG PHÁP SẢN XUẤT HIĐRO
Khoảng 75%
hiđro được sản xuất bằng quá trình
refominh hơi nước. Trong quá trình này hiđrocacbon (trong
khí thiên nhiên) và hơi nước được thực hiện
theo hai giai đoạn: Giai đoạn refominh sơ cấp
và refominh thứ cấp. Trong giai đoạn sơ cấp,
hỗn hợp hơi nước và hiđrocacbon được
nén đến áp suất khoảng 30 atm và được
đốt nóng trên chất xúc tác niken oxit ở khoảng 8000C.
Giai đoạn thứ cấp được thực hiện
ở nhiệt độ cao hơn (khoảng 10000C)
với sự có mặt của không khí để chuyển
hoá hiđrocacbon còn lại ở giai đoạn sơ cấp.
Hai phản ứng chính (với chất đại diện
là CH4) như sau:
CH4 (k)
+ H2O (k) -->CO (k) + 3H2 (k);
(1) DH >
0: giai đoạn sơ cấp
2CH4 (k)
+ O2 (k) --> 2CO (k) + 4H2 (k);
(2) DH >
0: giai đoạn thứ cấp
Khí H2 tạo
ra lẫn CO và hơi nước được dẫn qua
xúc tác CuO - ZnO ở khoảng 3000C:
CO + H2O --> CO2 + H2
Để tách H2
khỏi CO2 người ta dùng dung dịch K2CO3
hấp thụ CO2 ở áp suất cao:
CO2 + K2CO3
+ H2O --> 2KHCO3
Do cả hai phản
ứng (1) và (2) đều thu nhiệt, nên theo nguyên lí Lơ
Sa-tơ-li-ê, quá trình tạp ra sản phẩm thuận lợi
ở nhiệt độ cao.
Ở áp suất
cao không thuận lợi cho quá trình tạo ta H2 vì cả
hai phản ứng đều có số mol khí của sản
phẩm lớn hơn số mol khí của các chất phản
ứng. Tuy nhiên, trong thực tế các phản ứng trên
đều thực hiện ở áp suất cao, vì H2
tạo ra được sử dụng khép kín để tổng
hợp NH3 (đi từ N2 và H2, ở
áp suất cao hiệu suất tạo thành NH3 cao
hơn). Nhà máy phân đạm ở Phú Mĩ (Bà Rịa - Vũng
Tàu) sản xuất NH3 (sau đó thành uree) theo quy
trình khép kín này.
Khi phản ứng thuận nghịch ở
trạng thái cân bằng, nồng độ các chất trong
phản ứng không biến đổi nữa (nếu
điều kiện phản ứng không biến đổi),
nên có thể đưa ra một đại lượng
đặc trưng cho cân bằng, đó là hằng số
cân bằng.
Thí dụ: cho
0,6700 mol/l khí N2O4 ![]() 2NO2 (k)
2NO2 (k)
Khi phản ứng
ở trạng thái cân bằng thu được 0,0547 mol/l
khí NO2 và còn lại 0,6430 mol/l khí N2O4,
khi đó tỉ số sau là một hằng số:
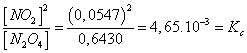
Ở đây: [NO2] và [N2O4] là nồng độ nol của khí NO2 và N2O4 ở trạng thái cân bằng; Kc là hằng số cân bằng (c là chữ viết tắt của từ concentration, nghĩa là nồng độ) của phản ứng. Giá trị Kc của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
Thực ra: [NO2] = ![]() và [N2O4]
=
và [N2O4]
= ![]() , nghĩa là nồng độ
mol của các chất trong biểu thức tính Kc
đã được chia cho nồng độ chuẩn
1,0000 mol/l nên các số 0,0547 và 0,6430 là những hư số,
do đó hằng số cân bằng Kc không có
đơn vị.
, nghĩa là nồng độ
mol của các chất trong biểu thức tính Kc
đã được chia cho nồng độ chuẩn
1,0000 mol/l nên các số 0,0547 và 0,6430 là những hư số,
do đó hằng số cân bằng Kc không có
đơn vị.
Trường hợp tổng quát:
aA + bB ![]() của + dD
của + dD
A, B, C và D là các chất khí hoặc các chất tan trong dung dịch.
Khi phản ứng thuận nghịch trên ở trạng thái cân bằng, ta có:
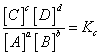
Trong đó, Kc là hằng số cân bằng của phản ứng. Đối với phản ứng xác định, Kc chỉ phụ thuộc vào nhiệt độ.
[A], [B], [C] và [D] là nồng độ mol của các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lệ các chất A, B, C và D trong phương trình hoá học của phản ứng.
Nồng độ các sản phẩm (ở vế phải của phương trình hoá học) được đặt ở tử số, còn nồng độ các chất phản ứng (ở vế trái của phương trình hoá học) được đặt ở mẫu số. Nếu trong cân bằng có chất rắn tham gia thì nồng độ chất rắn được coi là hằng số, nên nó không có mặt trong biểu thức hằng số cân bằng. Thí dụ:
C (r) + CO2 (k) ![]() 2CO
(k)
2CO
(k)
Kc = ![]()
Hằng số cân bằng có ý nghĩa rất lớn.
Nó cho biết lượng các chất phản ứng còn lại
và lượng các sản phẩm tạo ra ở trạng
thái cân bằng, do đó biết được hiệu suất
của phản ứng. Thí dụ:
CaCO3 (r)
![]() CaO (r) + CO2 (k)
CaO (r) + CO2 (k)
Kc = [CO2]
Ở 8200C, Kc = 4,28.10-3, do đó [CO2] = 4,28.10-3 mol/l.
Ở 8800C, Kc = 1,06.10-2, nên [CO2] = 1,06.10-2 mol/l.
Vậy, ở nhiệt độ cao hơn, khi phản ứng ở trạng thái cân bằng, lượng CO2 (đồng thời lượng CaO) tạo ra theo phản ứng nhiều hơn; nghĩa là ở nhiệt độ cao hơn, hiệu suất chuyển hoá CaCO3 thành CaO và Co2 lớn hơn.
A - KIẾN THỨC CẦN NẮM VỮNG
1. Tốc độ phản ứng tăng khi
a) Tăng nồng độ chất phản ứng(7)
b) Tăng áp suất chất phản ứng (nếu là chất khí)
c) Tăng nhiệt độ cho phản ứng (8)
d) Tăng diện tích bề mặt chất phản ứng.
e) Có mặt chất
xúc tác.
2. Cân bằng hoá học là trạng
thái của phản ứng thuận nghịch khi tốc
độ phản ứng thuận và tốc độ phản
ứng nghịch bằng nhau.
3. Sự chuyển dịch cân bằng
là sự di chuyển từ trạng thái cân bằng này sang
trạng thái cân bằng khác do tác động của các yếu
tố từ bên ngoài lên cân bằng (sự biến đổi
nồng độ, áp suất, nhiệt độ) được
thể hiện trong nguyên lý Lơ Sa-tơ-li-ê:
a) Khi tăng nồng độ một chất nào đó (trừ
chất rắn) trong cân bằng, cân bằng sẽ chuyển
dịch theo chiều phản ứng làm giảm nồng
độ chất đó và ngược lại.
b) Khi tăng áp suất chung của hệ cân bằng, cân bằng
sẽ dịch chuyển theo chiều phản ứng có số
mol khí ít hơn và ngược lại.
c) Khi tăng nhiệt độ, cân bằng sẽ chuyển
dịch theo chiều phản ứng thu nhiệt và ngược
lại.
(1) Natri thiosunfat.
(2) Khi tính tốc độ cần chỉ rõ tốc độ theo chất cụ thể nào trong phản ứng.
(3) Lưu huỳnh tạo thành nhiều sẽ có màu vàng nhạt
(5) Đối với chất khí, nồng độ mol/l là số mol khí có trong 1 lít khí.
(6) Có thể tiến hành thí nghiệm như hình 7.5
(7),(8) Trừ một số trường hợp ngoại lệ.

